CLSI 2 - 5 Jun 2018 AST meeting報告
(2018年6月2日~2018年6月5日:カリフォルニア州サンディエゴ)
舘田 一博(東邦大学)、大楠 清文(東京医科大学)
2018年6月2日~5日に開催されたClinical Laboratory Standards Institute (CLSI)のAntimicrobial Susceptibility Testingミーティングに、日本臨床微生物学会から国際委員の舘田一博 委員長(東邦大学)と大楠清文 委員(東京医科大学)が参加した。3日間にわたるプレゼンテーションおよびディスカッションが行われたので、決議事項を中心としてその概要をワーキンググループ別に報告する。なお、今回の会議で決定された事項については2019年1月のASTミーティングまでは最終ではなく、最終決定版はパブリックコメントを受けた上で2019年の1月に公表される予定である。

会議の前日に恒例となっているCLSI Education Workshop Presentationsが開催された。今回のトピックスはImplementation of the 21st Century Cures Act for Susceptibility Test Interpretive Criteriaと題して4名の演者が21st Century Cures Actについてプレゼンテーションを行った。4名の演者のスライドは以下のアドレスからすべてダウンロードできる;
https://clsi.org/media/2276/201862-edusession_21stcenturycures_final.pdf
会議の冒頭でCLSI UpdateとしてMr. Glen Fineから、このところ、AST会議への参加者が増加しており、今回は初めて参加された方が25名いること、無料版のM100, M60 (antifungal breakpoints), VET01 supplementへのアクセス数が20%増加したこと、などが報告された。
今回の会議で使用されたプレゼンテーションのスライドは、以下のアドレスからすべてダウンロードできる;
https://clsi.org/education/microbiology/ast/ast-meeting-files-resources/june-2018-ast-meeting-minutes-and-presentations/
Outreach Ad Hoc ワーキンググループ
最新トピックスを紹介するニュースレターとして、Volume 3, 2018年2号 Springが発刊( PDF No.1)されたことが報告された。
なお、本号に掲載されているトピックは以下の5項目である。
- Feature Article | Part 1
New β-lactam Combination Agents for the Treatment of Gram Negative Bacterial Infections: What the Clinical Microbiologist Needs to Know! - Feature Article | Part 2
Why All the Fuss Over Quality Control of β-lactam Combination Agents? - Case Study
Cefazolin, Urine, and Escherichia coli, Klebsiella pneumoniae, and Proteus mirabilis: Entertaining Solutions for Antimicrobial Susceptibility Testing and Reporting - Burning Question
What Should Clinical Laboratorians Know About Gonorrhea in 2018? - Hot Topic
It's Enough to mec You Crazy!
次号のニュースレター(2018年3号 Fall)は次の4項目の掲載が進行中であると報告された。
- A feature article on dosing antibiotics
- A case study on cefazolin testing for Enterobacteriaceae
- Practical tips on when perform yeast AST
- A hot topic on cefazolin and methicillin-susceptible S. aureus
今後のウエビナーとして以下の2つのトピックスを予定していることが報告された。なお、CLSIのウエビナーのHPアドレスを示す;https://clsi.org/education/webinars/
- Preparation, Presentation, and Promotion of Cumulative Antibiogram to Support Antimicrobial Stewardship Programs
- Resources for Implementation of MALDI-TOF MS in the Microbiology Laboratory
Methods Development and Standardization ワーキンググループ
Coagulase-Negative Staphylococcus (CoNS) AdHoc ワーキンググループ
質量分析装置の導入によって検査室でのCoagulase-Negative Staphylococcus (CoNS)の菌種レベルの同定精度が高くなったことことから、CoNSに対するoxacillinのブレイクポイントが適切かどうかを検討した。その結果、S. epidermidisに対するoxacillinのディスク拡散法(Disk diffusion: DD)のブレイクポイントを、S = >18 mm; R = <17 mm とすることが承認され、M100 29thのTable 2Cに追記される。
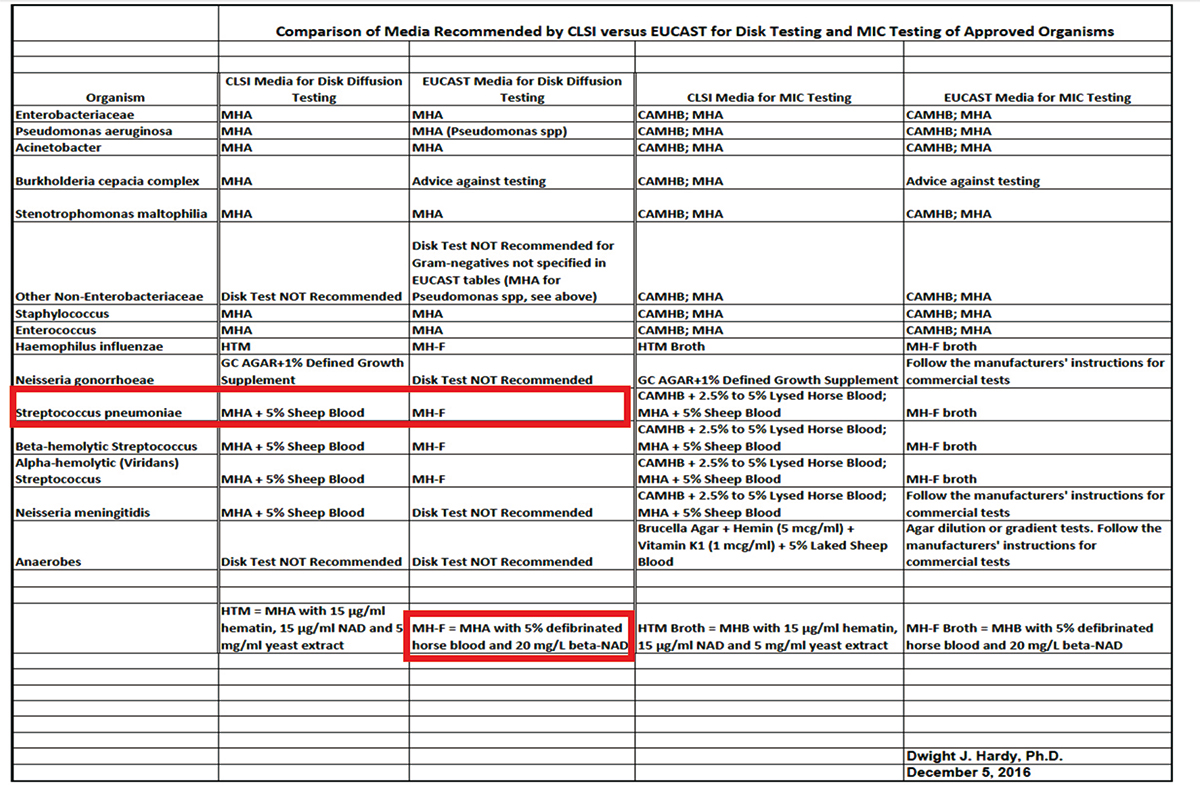
Comparison of CLSI and EUCAST Reference Media for S. pneumoniae Disk Diffusion AdHoc
薬剤感受性試験において、以下の表(2017年1月のCLSI会議資料)に示したように、CLSIとEUCASTが推奨している培地には、組成の違いがある。例えば、肺炎球菌のディスク拡散法で使用する培地として、CLSIはMHA supplemented with 5% sheep bloodを推奨しているのに対して、EUCASTはMueller-Hinton fastidious (MHF) (MHA supplemented with 5% mechanically defibrinated horse blood and β-NAD [20 mg/L])を推奨している。今回、MHFを使用してディスク拡散法で肺炎球菌の薬剤感受性試験を実施した場合に、CLSIのブレイクポイントとQCレンジに相違を認めるか否かを検討した。その結果、EUCASTが推奨しているMHFは、CLSIが使用している培地と同等であったことが示され、肺炎球菌の表に、測定条件としてこれらを追記することが承認された。
Ceftazidime-avibactam Disk Breakpoints
現在のCeftazidime-avibactam(CAZ-AVI)のブレイクポインは、腸内細菌科細菌と緑膿菌において、微量液体希釈法(BMD)では、 S ≥ 8/4 μg/ml; R ≤ 16/4 μg/ml、ディスク拡散法(Disk diffusion;DD)では、S ≤ 21 mm; R ≥ 20 mmである。今回、476株の腸内細菌科細菌および56株の緑膿菌、74株のCREなどのデータを解析・検討した結果、DDのブレイクポイントを変更することが提案された。すなわち、S = ≥ 20 mm; I = 18-19 mm; R = ≤ 17 mmとしてI = 18-19 mmを設定することが提案されたが、合意には至らず、最終的に、I = 18-19 mmの場合は以下のコメントのように、微量液体希釈法でMIC値の確認を推奨することが承認された(M100 29thに掲載);“Isolates with zones of 18-19 mm may test susceptible by MIC, confirmatory testing is indicated.”
Meropenem-Vaborbactam Breakpoint Proposal
Meropenem-vaborbactam のキーとなる細菌であるEnterobacteriaceae, CRE and KPC-producing CRE, P.aeruginosa, Acinetobacter, Stenotrophomonas, Burkholderia などに対するデータがPK/PDを含めて紹介された。その後、微量液体希釈法(BMD)とディスク拡散法(DD)のブレイクポイントが提示された。Enterobacteriaceae において、MIC: S =≤4/8; I = 8/8; R = 16/8、DD: S = ≥ 18 mm; I = 15-17 mm; R = ≤14 mmでTable 1AのGroup Bに掲載されることが承認された。さらに、meropenem-vaborbactam, ceftazidime-avibactam, ceftolozane-tazobactam は、Table 1AのGroup B に各々分けて収載すること、その他の3つの β-lactam系合剤は一緒にEnterobacteriaceaeのボックスに掲載することが承認された。
Ciprofloxacin-levofloxacin Disk Correlates for Enterobacteriaceae & Pseudomonas Breakpoints
腸内細菌科細菌と緑膿菌に対するCiprofloxacinとLevofloxacinの微量液体希釈法によるMICのブレイクポイントは既に承認されているが、ディスク拡散法(DD)のブレイクポイントはペンディング状態であった。今回、これらの追加検討データが提示され、最終的に、以下のブレイクポイントが承認された。
| Zone diameter in mm | ||||
|---|---|---|---|---|
| Susceptible | Intermediate | Resistant | ||
| Enterobacteriaceae | Ciprofloxacin | ≥26 | 22-25 | ≤21 |
| Levofloxacin | ≥21 | 17-20 | ≤16 | |
| Pseudomonas aeruginosa | Ciprofloxacin | ≥25 | 19-24 | ≤18 |
| Levofloxacin | ≥22 | 15-21 | ≤14 | |
Azithromycin Breakpoints for Neisseria gonorrhoeae (GC)
淋菌に対するアジスロマイシンのs; susceptibleのブレイクポイントとして、現在のECVと同じ「1 μg/ml」を提案し、承認された。また、Table 2F のGroup Aに本薬剤を収載して、以下のコメントを追記することも承認された;“This breakpoint presumes that azithromycin (1 gm single dose) is used in an approved regimen that includes an additional antimicrobial agent (ie, ceftriaxone 250mg IM single dose).”
Methods Application and Interpretation ワーキンググループ
Intermediate vs Susceptible-Dose dependent(SDD)AHWG Report
本AHWGでは、I; intermediateのカテゴリーの必要性とSDD; Susceptible-Dose dependentのカテゴリーを今後どのようにしたら良いかを議論している。そのようななかで、CLSIとEUCASTでブレイクポイントに対する考え方の違いが紹介された。
| EUCAST(S-I-R) | CLSI(S-I-SDD-R) |
|---|---|
Dosing
|
Susceptible Dose Dependent
|
Technical Uncertainty
|
Intermediate: Accounts for technical variation |
今後、CLSIとしては、EUCASTのS, I, Rの考え方にするのか?これまでのようにS, I, SDD, Rの概念を継続していくのか?EUCASTとCLSI双方のコンセプトのメリットとデメリット(PROS & CONS; 賛否)を整理した上で議論が展開された(下記の表を参照)。
| S-I-R | S-I-R or S-SDD-R |
|---|---|
|
|
| PROS | |
|
|
| CONS | |
|
|
最終的に、CLSIは、新規薬剤のブレイクポイント設定において、今後もS-I-R もしくは S-SDD-Rの3つのカテゴリー(SとRの2つのカテゴリーはなし、ただしSのみの設定はあり)を継続していくことが承認された。また、現状のドキュメントに記載されている薬剤も同様であることが承認された。
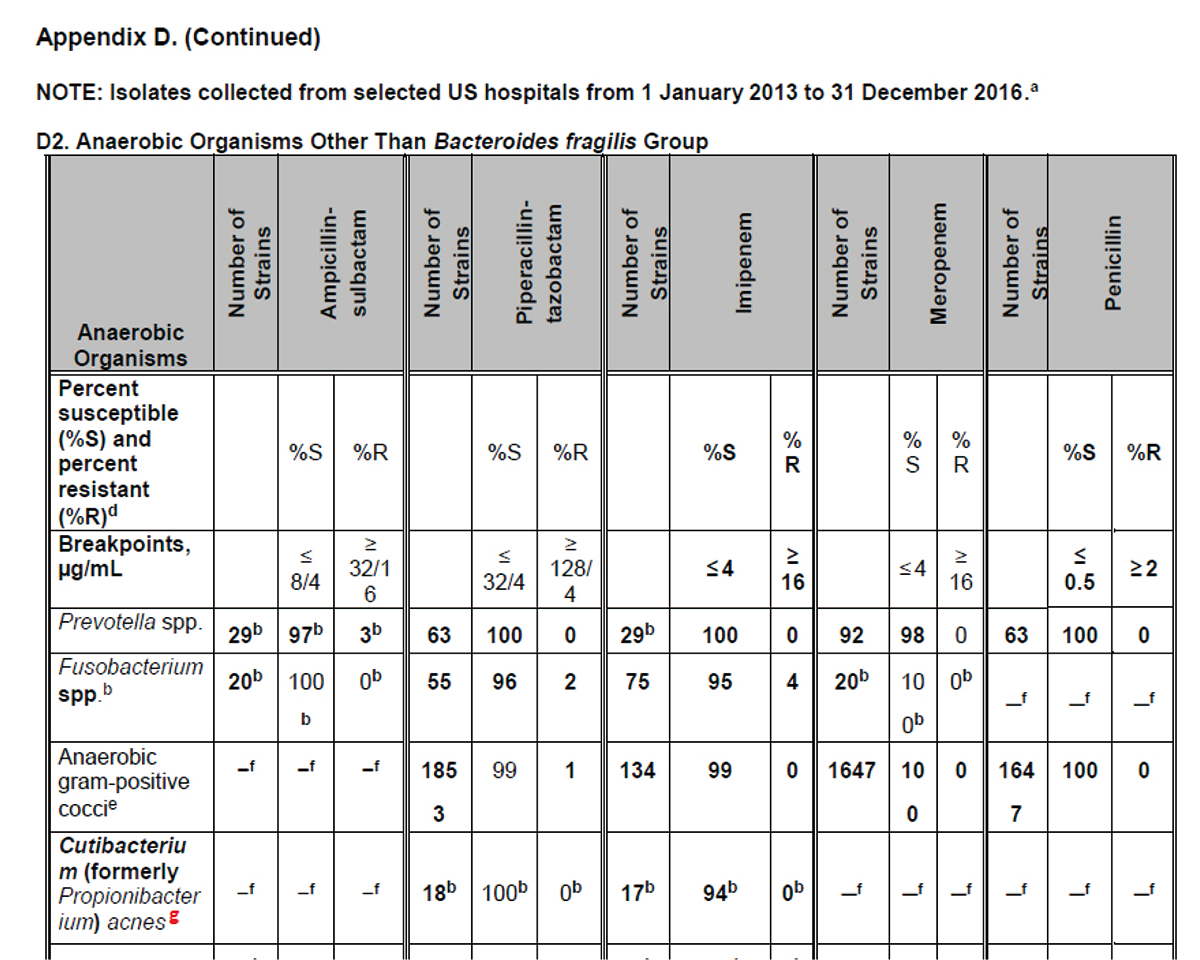
Anaerobe WG Report
バイオアンチグラムAppendix Table D2 (下記の表)でCutibacterium (formerly Propionibacterium)のリファンピシンに関するコメントとして、以下の文章を注釈として記載することが承認された。
“80 isolates of Cutibacterium (Propionibacterium) acnes from two of the sites generated MIC values for rifampin ≤0.03 μg/mL using the agar dilution method. There are no interpretive breakpoints for this organism/antimicrobial agent combination.”
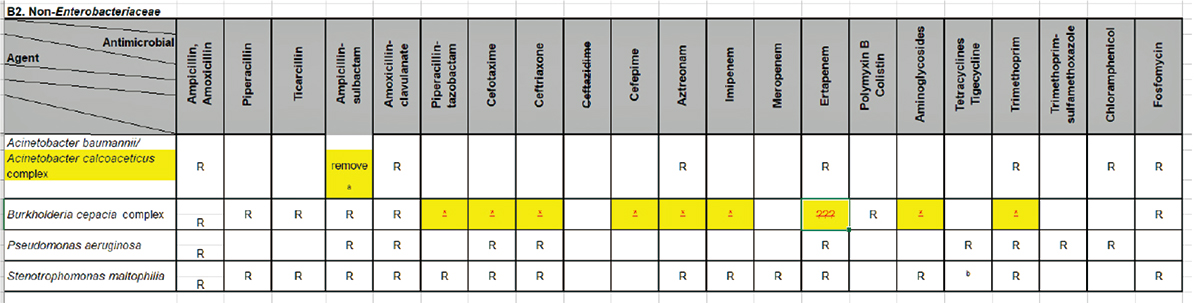
Intrinsic Resistance (IR) WG Report
自然耐性(IR)の表(Appendix B2)に以下の変更を行うことが検討され、すべて承認された。
― A. baumannii/ calcoaceticus complexの欄でampicillin-sulbactamのRを削除する。
― Burkholderia cepacia complexの欄でPiperacillin-tazobactam、Cefotaxime、Ceftriaxone、Cefepime、Aztreonam、Imipenem、Aminoglycosides、TrimethoprimのRを削除する。脚注として以下の文章を追加する(文章は編集される可能性あり);“B. cepacia complex isolates have chromosomal genes that encode resistance mechanisms that may not be expressed, resulting in susceptible or low MIC testing results. Recall, intrinsic resistance implies the presence of resistance mechanisms in natural or wild-type strains that result in phenotypic resistance for all or nearly all strains. Environmental B. cepacia complex strains have low MICs to many antimicrobials whereas clinical strains, such as those from cystic fibrosis patients, have very high MIC values to most antimicrobials. There is insufficient clinical evidence to confirm whether or not strains that test susceptible, despite the presence of chromosomal resistance genes, will be eradicated in vivo. Therefore, the Intrinsic Resistance Working Group was unable to confirm strains as intrinsically resistant.” Note: The comment may be edited.
Appendix B2
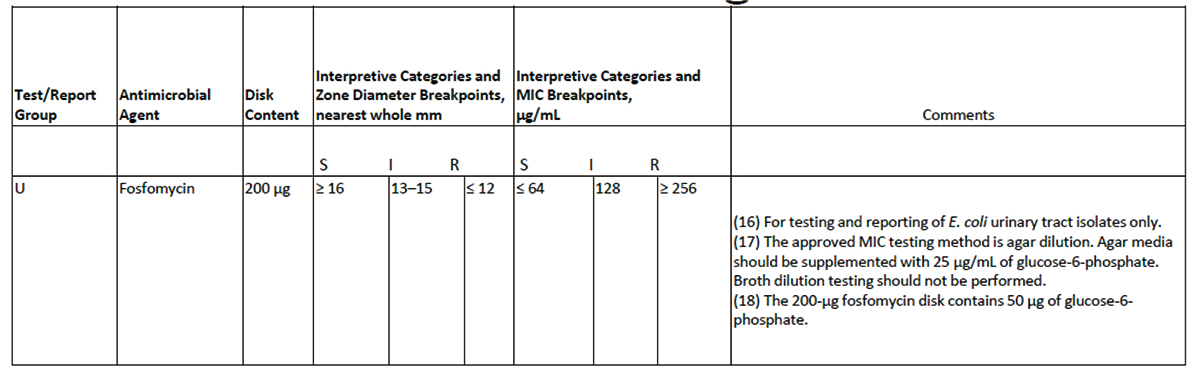
Fosfomycin Susceptibility Testing AHWG Report
Table 2Aにおいて、non-E.coli Enterobacteriaceae とP.aeruginosaにおけるホスホマイシンの薬剤感受試験に関するコメント; (16) For testing and reporting of E.coli urinary tract isolates only. を以下のような2つの文章に差し替えることが承認された。
(16a)“Disk diffusion testing is appropriate for testing and reporting of E.coli urinary tract isolates only.”
(16b)“Interpretive criteria apply only to E.coli urinary tract isolates and should not be extrapolated to other species of Enterobacteriaceae.”
ブレイクポイントワーキンググループ
Reassessment of Daptomycin Breakpoints for Enterococci
Enterococciに対するDaptomycinのブレイクポイントについて、Susceptible: ≤1 μg/mL*、Susceptible-Dose Dependent (SDD): 2-4 μg/mL**、Resistant: ≥ 8 μg/mLおよび以下のコメントを記載することが承認された;*Based on a dosage regimen of 6 mg/kg/day in adults. **The S-DD category is based on a dosage regimen of 8-12 mg/kg in adults and is intended for serious infections due to Enterococcus spp. Consultation with an infectious diseases specialist is recommended.
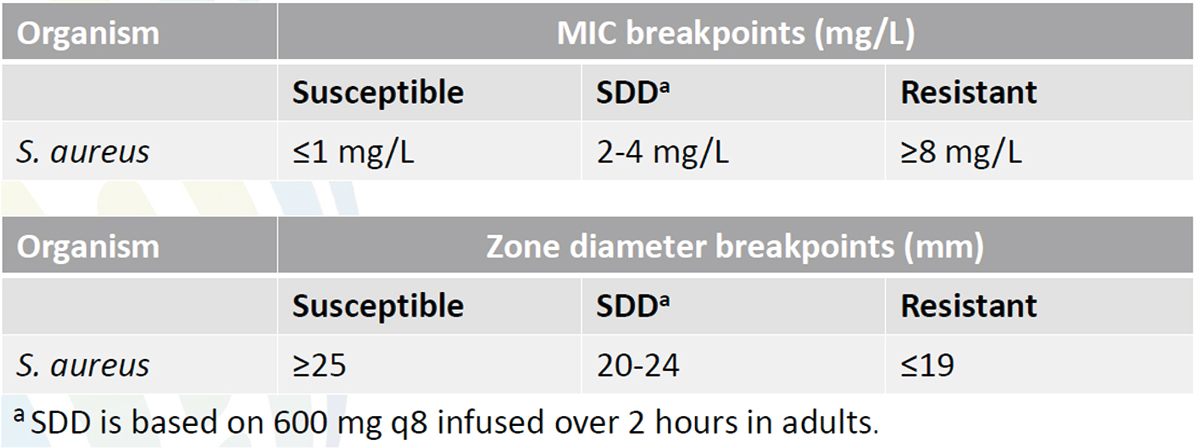
Evaluation of Ceftaroline Breakpoints for S. aureus
S. aureusに対するCeftarolineのMICとDDのブレイクポイトが以下の内容で承認された。
Cefiderocol Breakpoint Request
これまでのCLSI会議において、塩野義製薬で開発された新規抗菌薬 Cefiderocol; S-69266(siderophore cephalosporin)の薬剤感受性試験に関して、本薬剤の作用メカニズムを考慮して通常のCAMHBではなく、鉄制限下の培地(cation-binding resin treated MHB)を用いることが承認されたことを紹介した。今回の会議では、ブレイクポイントの設定において、serine- and metallo-type carbapenemases に対してcarbapenems やcephalosporinsと比較して、Cefiderocolは安定性に極めて優れていること、PK-PD modelおよび動物モデル(ラット)の詳細なデータの紹介、臨床データのレビューなどが実施された。その結果、以下のブレイクポイントをTable 2に掲載することが承認された(Investigational; INVとして、今後も治験を継続しながら、データをレビューする)。
| MICs (μg/ml) | |||
|---|---|---|---|
| Susceptible | Intermediate | Resistant | |
| Enterobacteriaceae | <4 | 8 | >16 |
| Pseudomonas aeruginosa | <4 | 8 | >16 |
| Acinetobacter baumannii | <4 | 8 | >16 |
| Stenotrophomonas maltophilia | <4 | 8 | >16 |
Quality Controlワーキンググループ
今回の会議で承認された薬剤毎のQC株とそのレンジを以下に示す。
| QC Strain | Range (μg/ml) | Comments |
|---|---|---|
| E.coli ATCC 25922 | 0.03/0.06-0.12/0.25 | |
| E.coli ATCC 5218 | 0.03/0.06-0.12/0.25 | |
| E.coli NCTC 13353 | 0.06/0.12-0.25/0.5 | Add footnote to explain not to use for routine QC. |
| K.pneumoniae ATCC 700603 | 0.03/06-0.25/0.5 | Shoulder 87% @ 0.06/0.12 Recommended routine QC strain for combination |
― Footnotes
| QC Strain | Range (μg/ml) | Comments |
|---|---|---|
| E.coli ATCC 25922 | 0.25-1 | Currently approved range |
| E.coli ATCC 35218 | 0.12-0.5 | |
| E.coli NCTC 13353 | 32-128 | 100% of results at mode (64) Identify as QC integrity strain* |
| K.pneumoniae ATCC 700603 | 4-32 | Identify as QC integrity strain* |
o No footnotes
| QC Strain | Range (mm) |
|---|---|
| N.gonorrhoeae 49226 | 32-40 |
o No footnotes
| QC Strain | Range (mm) | Comments |
|---|---|---|
| E.coli ATCC 25922 | 27-33 | Lab 7 mode outlier |
| P.aeruginosa ATCC 27853 | 26-31 | |
| K.pneumoniae ATCC 700603 | 26-32 | |
| K.pneumoniae ATCC BAA-1705 | 23-29 | Routine QC strain |
| K.pneumoniae ATCC BAA-2814 | 21-28 22-28 |
Lab 3 mode outlier. Approved smaller range for better control. Routine QC strain |
― Footnotes
o Add to footnote: “QC ranges for (drug name) were established using data from only one disk manufacturer. Disks from other manufacturers were not available at the time of testing.”
| QC Strain | Range (mm) |
|---|---|
| K.pneumoniae ATCC BAA-1705 | 11-22 |
| K.pneumoniae ATCC BAA-2814 | 6-14 |
― Footnotes
Read inner colonies for zone diameter
| QC Strain | Range (mm) |
|---|---|
| E.coli ATCC 25922 | 30-37 |
| P.aeruginosa ATCC 27853 | 19-27 20-26 |
| K.pneumoniae ATCC 700603 | 26-32 |
― Footnotes
QC range for K.pneumoniae ATCC 700603 with tebipenem is 26-32 and is considered a supplemental QC strain and is not required for routine QC of tebipenem MIC tests.
Text and Tableワーキンググループ
- M100のTable 2F. Zone Diameter and MIC Breakpoint for Neisseria gonorrhoeaeから4種類のキノロン系薬剤(Enofloxacin, Lomefloxacin, Ofloxacin, Fleroxacin)を削除することが承認された。
- M100のTable 2F. Zone Diameter and MIC Breakpoint for Neisseria gonorrhoeaeから6種類のセファロスポリン薬剤(Cefoxitin, Cefuroxime, Cefmetazole, Cefotetan, Ceftazidime, Cefetamet)を削除することが承認された。
次回のASTミーティング
次回のCLSI(Clinical and Laboratory Standards Institute) AST(Antimicrobial Susceptibility Test)ミーティングは、2019年1月26日~29日に、米国フロリダ州セントオーガスティンで開催されることが報告された。
(文責:大楠清文)